研究表明,过量低密度脂蛋白(LDL)向动脉壁的输运和堆积是动脉粥样硬化发生的早期事件。血管内皮细胞作为分子筛,在调控水分子及溶质向动脉壁的输运方面,发挥了重要作用。生理条件下,水分子及溶质跨内皮输运受到血流产生的流动剪切力影响,不同的血管床,此种现象明显程度存在差异。然而,到目前为止,实现在体外流动剪切力加载下,水分子和低密度脂蛋白跨内皮输运的定量测量,仍是一大难题。
本研究改进了物质传输测定系统,首次在体外完成了剪切力作用下,内皮细胞对水分子及低密度脂蛋白(LDL)的通透率的同时测定。研究表明,在剪切力加载3h 后,水的渗流速率Jv 可达到其基线水平的2.37±0.24 倍,达到同时刻静态水平的3.10 倍。有趣的是,L-NMMA 处理后,NO 的合成受到抑制,进而直接抑制了剪切力引起的Jv 增大现象,表现出与静态组相似的反应曲线。这提示我们,流动剪切力加载引起的Jv 增大现象主要是由NO 介导的。
另一方面,剪切力作用下,内皮细胞对LDL的通透性(Pe)则具有时间依赖性:短时间(3h)作用可引起通透性增大至基线水平的3.00±0.46倍,而伴随剪切力施加时间的延长,Pe呈现出规律变化:在4h、6h、8h末,Pe较其baseline依次增大2.24±0.54、2.42±0.56、3.25±0.95倍;到12h末,Pe又回归到近似基线水平(0.87±0.26)。
通过TUNEL技术,我们对静态或剪切力作用4h及12h后的内皮细胞凋亡率进行了测定。剪切力作用下,4h后,细胞凋亡率较0h提高到2.28±0.36倍,随着作用时间增至12h,细胞凋亡率又回降,维持在较低水平(shear: 1.33 ± 0.37 fold vs. static control: 1.46 ± 0.35fold, P>0.05)。此种变化趋势正好与剪切力作用下Pe的变化一致。
进一步地,我们建立了物质跨内皮输运的“三孔模型”。具体来讲,三孔包括:跨细胞囊泡(transcellular/vesicle)、断裂的紧密连接带(breaks in the tight junction,平均尺寸20nm)、大孔洞(leakyjunction,平均尺寸600nm)。通过模型简化,计算得到,流动剪切力作用下,断裂的紧密连接带对水的输运贡献份额高达78%,另外22%的水是通过细胞凋亡或增殖产生的大孔洞来输运的。相形之下,84.5%的LDL穿过大孔洞实现跨膜输运,仅有15.5%的LDL是通过囊泡运输。
该项研究再次验证了,细胞凋亡所产生的大孔洞(leaky junction)是LDL跨内皮输运的主要通路。生理水平的剪切力长期作用,可抑制内皮细胞凋亡,从而降低LDL向动脉壁的输运和沉积,对血管具有保护作用。
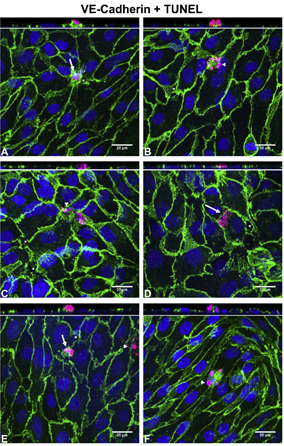
图 牛胸主动脉内皮细胞(BAEC)单层的激光共聚焦扫描图。绿色:VE-cadherin;蓝色:DAPI染细胞核;红色:TUNEL染色代表凋亡细胞。Arrows标出开始凋亡的细胞;Arrowheads指出凋亡小体;星号部分是细胞凋亡产生的leaky junction。(A) 和(B) 静态组; (C) 和 (D)流动剪切力加载组; (E) 和 (F) 流动剪切力作用同时L-NMMA处理。

